段成国研究组合作揭示植物SUVH6酶催化位点特异H3K9甲基化的分子基础
2022年12月29日,国际学术期刊PNAS在线发表了中国科学院分子植物科学卓越创新中心段成国研究组与南方科技大学杜嘉木研究组合作完成的题为“Molecular Basis of Locus-specific H3K9 Methylation Catalyzed by SUVH6 in Plants”的研究论文。该研究揭示了植物中保守的SUVH6组蛋白甲基转移酶家族催化位点特异H3K9甲基化的新机制。在该机制中,SUVH6家族N端一个未被解析的肽段结构可被染色质调控因子ASI1的BAH结构域特异识别。SUVH6-ASI1模块控制大多数SUVH6靶点上H3K9me2的沉积,并根据靶位点的位置对基因表达产生不同的调控模式,包括转录沉默或转录后调控。更重要的是,这种机制及其关键的氨基酸位点在植物中保守存在,表明SUVH6和ASI1之间存在共同进化。
作为真核生物异染色质的标志物,组蛋白H3K9甲基化在常染色质区域也会起到调控作用。模式植物拟南芥中的H3K9me2主要由SUVH4(KYP),SUVH5和SUVH6共同催化,并且与DNA甲基化存在正反馈调节作用以增强该区域的异染色质化。其中,SUHV4是最主要的催化酶,SUVH5和SUVH6作为辅助酶存在一定的功能冗余。然而,除了DNA甲基化介导的SUVH招募机制,植物中是否还有其他机制更精细地决定SUVH催化的位点特异性尚不清楚。
该研究组分别在拟南芥和水稻中通过免疫沉淀质谱分析鉴定到SUVH6的一个互作蛋白ASI1。ASI1是段成国课题组发现的识别H3K9me2并控制RNA加工的AAE(Asi1-Aipp1-Edm2)复合体的一个关键组分(Duan et al., 2017; You et al., 2021; Zhang et al., 2021)。经过蛋白截断互作实验将互作定位到SUVH6家族蛋白N端一段从未报道过的保守肽段,生化证据表明该肽段对于SUVH6和ASI1的互作是必须的。通过与杜嘉木教授课题组合作,解析了ASI1-BAH结构域与SUVH-N端多肽的高分辨率晶体结构,发现ASI1-BAH存在一个经典的芳香笼可以通过cation-π相互作用特异性识别SUVH6 N端的精氨酸残基,该单个精氨酸残基对ASI1-SUVH6互作具有决定性作用。染色质免疫沉淀测序(ChIP-seq)分析表明,SUVH6结合的染色质位点绝大部分被ASI1覆盖,而且ASI1与SUVH6在共同靶点上的定位依赖于这种互作,而且点突回补材料也表明关键精氨酸的突变可以直接影响SUVH6的染色质定位。H3K9me2 ChIP-seq分析表明ASI1-SUVH6互作模块促进了靶位点上H3K9me2的沉积,并以位置依赖的方式影响基因的表达:促进转录沉默或转录后mRNA的全长转录本加工。有趣的是,ASI和SUVH6的N端多肽只存在于植物中,并且在绝大部分植物中同时表达,暗示了其进化上的一致性。总之,该研究发现了植物中保守存在的一种H3K9me2自我增强正反馈回路,该通路与DNA甲基化介导的SUVH组蛋白甲基转移酶招募机制相互促进,增强H3K9me2在特定染色质位点的沉积。
分子植物科学卓越创新中心的博士生张健,已毕业博士生袁建龙和福建农林大学副教授林俊城为该论文的共同第一作者。中科院分子植物卓越中心段成国研究员和南方科技大学杜嘉木教授为该论文共同通讯作者。该研究得到了中科院先导项目,深圳市科技计划项目和广东省普通高校植物细胞工厂分子设计重点实验室等项目的资助。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2211155120
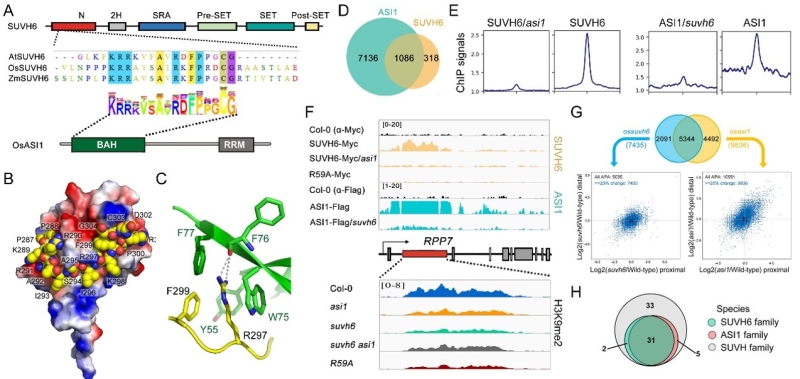
图1. A. SUVH6家族N端保守肽段与ASI1家族BAH结构示意图;B-C. ASI1-BAH与SUVH-N肽段互作结构及关键氨基酸示意图;D-F. ASI1与SUVH6在染色质上的共定位及相互依赖; G. 水稻中ASI1-SUVH6模块控制的APA位点;H. 植物种群SUVH家族共进化示意图
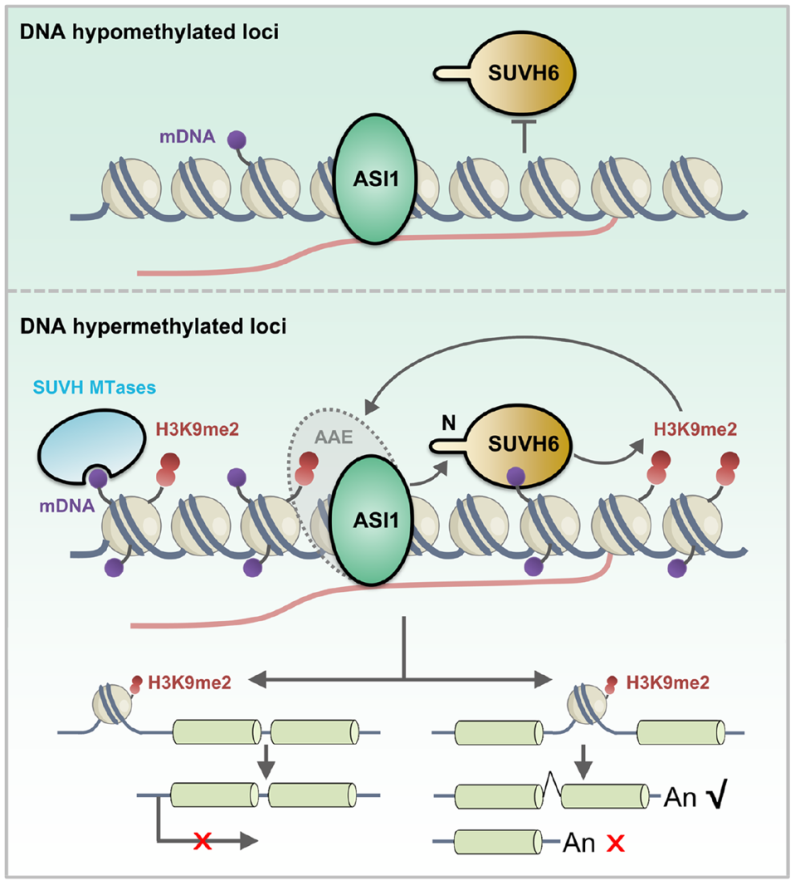
图2. SUVH6-ASI1模块调控H3K9me2沉积及基因表达的工作模型